- História položiek
- Všeobecné vlastnosti cínu
- Zliatiny na báze cínu
- Použitie prvku a jeho spojenia
- Účinky cínových zlúčenín
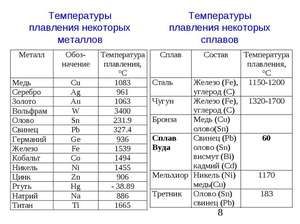
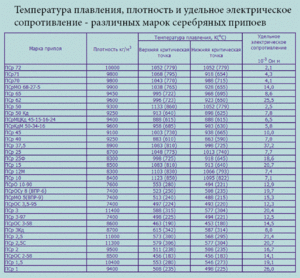 Cín je mäkký strieborno-biely kov. Je taká poddajná a poddajná, že jej plachty tisíciny milimetra hrubé môžu byť zvinuté do rúrky. Takýto materiál sa nazýva cínový papier. V periodickej tabuľke prvkov D. I. Mendeleeva tento prvok zodpovedá číslu 50, atómovej hmotnosti 118, 69 a znaku „Sn“ (s latinkou stannum). Je známych 10 jeho stabilných izotopov. Kov sa získava hlavne z kasiteritového minerálu, ktorým je oxid cínu.
Cín je mäkký strieborno-biely kov. Je taká poddajná a poddajná, že jej plachty tisíciny milimetra hrubé môžu byť zvinuté do rúrky. Takýto materiál sa nazýva cínový papier. V periodickej tabuľke prvkov D. I. Mendeleeva tento prvok zodpovedá číslu 50, atómovej hmotnosti 118, 69 a znaku „Sn“ (s latinkou stannum). Je známych 10 jeho stabilných izotopov. Kov sa získava hlavne z kasiteritového minerálu, ktorým je oxid cínu.
Na spájkovanie sa väčšinou používa kov v zliatine s olovom. Okrem toho sa používa ako antikorózna vrstva pre nádoby z potravinárskej ocele, pretože nie je toxická. Kompozity s cínom sa používajú ako fungicídy, farby, zubné pasty (SnF2) a keramika.
História položiek
 Tento prvok objavil v roku 1854 Halyus Pelegrin. Jeho používanie sa však začalo už dávno pred týmto dátumom na Blízkom východe a na Balkáne okolo roku 2000 pred Kristom. V tej dobe sa objavil bronz (zliatina cínu a medi), ktorá dala pomenovaniu doba bronzová. Vyrábali bronzové zbrane a nástroje, ktoré boli účinnejšie ako kameň a kosti.
Tento prvok objavil v roku 1854 Halyus Pelegrin. Jeho používanie sa však začalo už dávno pred týmto dátumom na Blízkom východe a na Balkáne okolo roku 2000 pred Kristom. V tej dobe sa objavil bronz (zliatina cínu a medi), ktorá dala pomenovaniu doba bronzová. Vyrábali bronzové zbrane a nástroje, ktoré boli účinnejšie ako kameň a kosti.
V staroveku viedla výroba bronzu k rozvoju obchodu medzi rôznymi krajinami. V Starom zákone sú tiež odkazy na tento kov. Takže v Mezopotámii vyrobili bronzové zbrane av starom Ríme pokryli cínovým vnútorným povrchom medených nádob, aby zvýšili svoju odolnosť proti korózii.
Všeobecné vlastnosti cínu
Všetky vlastnosti tohto kovu možno rozdeliť do dvoch veľkých skupín : fyzikálne a chemické.
Fyzikálne vlastnosti
 Je to strieborný kujný kov, ktorý pri teplote miestnosti ľahko oxiduje, zatiaľ čo farba cínu sa mení na tmavosivú. Ak ohnete dosku z tohto kovu, môžete počuť charakteristický zvuk, tzv. „Cínový plač“, ktorý sa objavuje v dôsledku trenia medzi jeho kryštalickými kryštálmi. Jednou z výrazných charakteristík je prudké zhoršenie mechanických vlastností, ktoré sa za určitých podmienok nazýva „mor cínu“: pri teplote pod -18 ° C sa kov ničí a začína vyzerať ako sivý prášok.
Je to strieborný kujný kov, ktorý pri teplote miestnosti ľahko oxiduje, zatiaľ čo farba cínu sa mení na tmavosivú. Ak ohnete dosku z tohto kovu, môžete počuť charakteristický zvuk, tzv. „Cínový plač“, ktorý sa objavuje v dôsledku trenia medzi jeho kryštalickými kryštálmi. Jednou z výrazných charakteristík je prudké zhoršenie mechanických vlastností, ktoré sa za určitých podmienok nazýva „mor cínu“: pri teplote pod -18 ° C sa kov ničí a začína vyzerať ako sivý prášok.
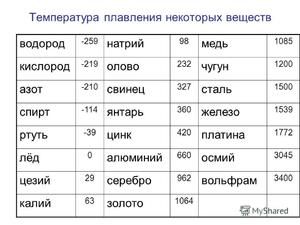
Čistý cín má dve allotropické modifikácie: sivú a bielu. Šedá modifikácia má kubickú kryštalickú štruktúru, je polovodič veľmi krehká, má nízku hustotu a je stabilná pri teplotách pod 13, 2 ° C. Biela allotropická modifikácia má tetragonálnu kryštalickú štruktúru, dobre vedie elektrický prúd a je stabilná pri teplotách nad 13, 2 ° C.
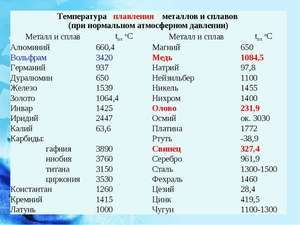
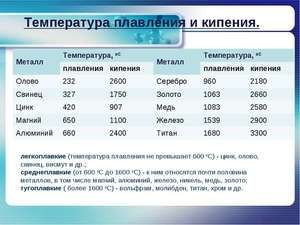
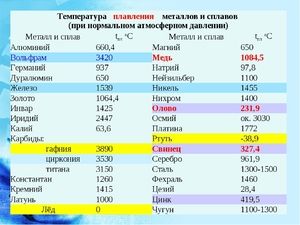
Kov sa topí pri relatívne nízkej teplote 232 ° C (na porovnanie: železo sa topí pri 1535 ° C). Je potrebné pochopiť, pri odpovedi na otázku, pri akej teplote sa cín topí, v čom presne sa topí jej biela alotrópická modifikácia. Napriek nízkemu bodu topenia dochádza k varu kovu pri relatívne vysokej teplote 2602 ° C (železo vrie pri 2750 ° C).
Chemické vlastnosti
 Najdôležitejším minerálom je kasiterit, SnO2. V súčasnosti však nie sú známe rudné ložiská s vysokým percentom tohto minerálu. Väčšina cassiteritu na svete sa ťaží z nízko kvalitných náplavových ložísk. Z tohto minerálu sa cín vyrába v priemyselnom meradle. Za týmto účelom sa kasiterit rozdrví, aby sa získal jeho koncentrát, a potom sa roztaví spolu s koksom, kremeňom a vápnom vo vysokej peci. Potom odliatky vo forme blokov prechádzajú konečným čistením od nečistôt bizmutu, medi a železa.
Najdôležitejším minerálom je kasiterit, SnO2. V súčasnosti však nie sú známe rudné ložiská s vysokým percentom tohto minerálu. Väčšina cassiteritu na svete sa ťaží z nízko kvalitných náplavových ložísk. Z tohto minerálu sa cín vyrába v priemyselnom meradle. Za týmto účelom sa kasiterit rozdrví, aby sa získal jeho koncentrát, a potom sa roztaví spolu s koksom, kremeňom a vápnom vo vysokej peci. Potom odliatky vo forme blokov prechádzajú konečným čistením od nečistôt bizmutu, medi a železa.
Chemický prvok cín dobre reaguje so silnými kyselinami a silnými zásadami, ale v neutrálnych roztokoch je relatívne inertný. Koroduje sa v prítomnosti oxidačného média, v neprítomnosti kyslíka kov prakticky koroduje. Počas oxidácie sa na povrchu kovu vytvára hustý oxidový film, ktorý ho chráni pred ďalšou oxidáciou.
 Ak sa kyslé médium vytvorí po rozpustení solí vo vode, potom v prítomnosti oxidačných činidiel alebo vzduchu, cín reaguje. Takéto soli zahŕňajú chloridy, napríklad hliník a železo. Väčšina nevodných kvapalín, ako sú oleje a alkoholy, prakticky nereaguje s cínom. Samotný cín a jeho jednoduché anorganické soli nie sú toxické, niektoré organické kompozity sú však toxické.
Ak sa kyslé médium vytvorí po rozpustení solí vo vode, potom v prítomnosti oxidačných činidiel alebo vzduchu, cín reaguje. Takéto soli zahŕňajú chloridy, napríklad hliník a železo. Väčšina nevodných kvapalín, ako sú oleje a alkoholy, prakticky nereaguje s cínom. Samotný cín a jeho jednoduché anorganické soli nie sú toxické, niektoré organické kompozity sú však toxické.
Oxid cínatý, SnO je čierno-modrý kryštál, ktorý sa rozpúšťa v kyselinách a zásadách. Používa sa na výrobu solí pri elektrolytickom pokovovaní a pri výrobe skla. Oxid cínatý, SnO2 je biely prach, nerozpustný v kyselinách. Používa sa ako nevyhnutná súčasť na farbenie v ružovej, žltej a hnedej keramike, ako aj v dielektrikách a žiaruvzdorných zliatinách. Je to dôležitý prostriedok pri leštení mramoru a iných dekoratívnych kameňov.
Chlorid cínatý, SnCl2 je hlavnou zložkou kyseliny cínovej na spájkovanie. Chlorid cínatý, SnCl4 sa používa ako chemická zložka na priberanie na hmotnosti hodvábnej textílie, ako aj na stabilizáciu určitých parfumových výrobkov a stabilizáciu farby mydla a ako prísada do zubných pást sa používa SnF2, ktorý je biely a rozpustný vo vode.
Organické chemické zlúčeniny založené na tomto prvku sú tie zlúčeniny, v ktorých je prítomná aspoň jedna väzba cín-vodík, Sn-H, a v ktorých kov vykazuje oxidačný stav +4. Organické zlúčeniny, ktoré našli uplatnenie v priemysle, majú nasledujúce chemické vzorce:
- R4Sn;
- R3SnX;
- R2SnX2;
- RSnX3.
Tu R je organická skupina, napríklad metyl, etyl, butyl a ďalšie, a X je anorganický prvok, napríklad chlór, kyslík, flóra a ďalšie.
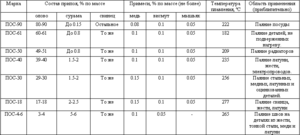
Zliatiny na báze cínu
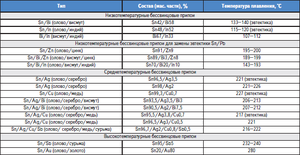 Zliatiny na báze cínu sú známe aj ako biele kovy, obvykle obsahujúce meď, antimón a olovo. Zliatiny majú rôzne mechanické vlastnosti v závislosti od ich zloženia.
Zliatiny na báze cínu sú známe aj ako biele kovy, obvykle obsahujúce meď, antimón a olovo. Zliatiny majú rôzne mechanické vlastnosti v závislosti od ich zloženia.
Cín a zliatiny olova našli svoje komerčné využitie pre široké spektrum zlúčenín. Takže 61, 9% cínu a 38, 1% olova zodpovedá eutektickej zmesi, ktorej stupeň tuhnutia je 183 ° C. Zliatiny s rôznym pomerom týchto kovov sa topia a kryštalizujú v širokom teplotnom rozmedzí, keď existuje rovnováha medzi pevnou a kvapalnou fázou. Pri takejto kryštalizácii sa začínajú v tavenine zrážať tuhé segregácie, čo vedie k tvorbe rôznych štruktúr. Eutektická zliatina, pretože má najnižšiu teplotu topenia, sa používa ako ochrana pred prehriatím elektronických komponentov.
Existujú tiež zliatiny, v ktorých je okrem týchto kovov prítomné malé množstvo antimónu (až do 2, 5%). Hlavným problémom zliatin na báze cínu a olova je ich negatívny vplyv na životné prostredie, preto sa nedávno vyvinuli ich náhrady, v ktorých sa olovo nepoužíva, napríklad zliatiny so striebrom a meďou.
Zliatiny cínu s olovom a antimónom sa používajú ako ozdobné šperky a niektoré zliatiny cínu, medi a antimónu sa používajú ako mazivo na zníženie trenia v ložiskách v dôsledku svojich antikrižovacích vlastností. Okrem vyššie uvedených zliatin sa cín používa v bronzových zliatinách a v zliatinách s titánom a zirkónom.
Použitie prvku a jeho spojenia
Nižšie sú uvedené všetky oblasti ľudskej výroby, v ktorých sa tento prvok priamo alebo nepriamo používa:
 Ochrana proti korózii a mechanickému namáhaniu ocelí a iných kovov, napríklad pri výrobe plechoviek;
Ochrana proti korózii a mechanickému namáhaniu ocelí a iných kovov, napríklad pri výrobe plechoviek;- Zníženie krehkosti skla, ako aj pri výrobe zrkadiel;
- V naháňaných vzoroch na rôznych jedlách;
- Použitie vo fungicídoch, farbách, zubných pastách a rôznych pigmentoch.
- Po prijatí rôznych zliatin, napríklad bronzov.
- Na spájkovanie pri nízkej teplote alebo mäkké spájkovanie;
- Skladané s olovom pri výrobe plechov pre hudobné nástroje;
- Výroba etikiet rôznych výrobkov;
- V zliatinách, ktoré chránia pred prehriatím elektrických prístrojov a elektronických mikroobvodov;
- V keramickom priemysle na výrobu smaltov ako matovacích činidiel.
- V kapsuliach na uzávery fliaš vína. Výroba takýchto kapsúl sa po zákazu používania olova v potravinárskom priemysle rozšírila.
Účinky cínových zlúčenín
Aktivita zlúčenín s týmto prvkom tak či onak ovplyvňuje ľudské telo aj životné prostredie.
O ľudskom zdraví
 Ako už bolo uvedené, najnebezpečnejšie pre ľudské zdravie sú organické chemické zlúčeniny cínu. Tieto látky sa široko používajú v priemysle, napríklad pri výrobe farieb, plastov a pesticídov pre poľnohospodárstvo. Okrem toho výroba organických zlúčenín s týmto kovom neustále rastie, a to aj napriek tomu, že sú známe následky ich otravy .
Ako už bolo uvedené, najnebezpečnejšie pre ľudské zdravie sú organické chemické zlúčeniny cínu. Tieto látky sa široko používajú v priemysle, napríklad pri výrobe farieb, plastov a pesticídov pre poľnohospodárstvo. Okrem toho výroba organických zlúčenín s týmto kovom neustále rastie, a to aj napriek tomu, že sú známe následky ich otravy .
Účinky týchto látok na ľudí sú rôzne, všetko závisí od typu zlúčeniny a od individuálnych charakteristík tela. Nebezpečenstvo zlúčeniny koreluje s dĺžkou väzby medzi kovom a vodíkom, čím dlhšie je toto spojenie, tým menej nebezpečné je spojenie. Z tohto hľadiska sa zlúčenina cínu s tromi etylovými skupinami, ktorých vodíkové väzby sú relatívne krátke, považuje za najnebezpečnejšiu organickú látku.
Tieto látky sa môžu dostať do ľudského tela potravou, vzduchovými kvapkami alebo sa ich jednoducho dotknúť. Známe sú nasledujúce účinky účinkov organických zlúčenín cínu na ľudské telo:
- V miestnosti obsahujúcej výpary tohto kovu silné podráždenie horných dýchacích ciest, pokožky a očí;
- Bolesť hlavy, bolesti žalúdka a nechutenstvo;
- Nevoľnosť a zvracanie;
- Problémy s močením;
- Ťažké potenie a dýchavičnosť.
Uvedené účinky môžu viesť k vážnejším následkom:
- depresie;
- Problémy s pečeňou;
- Poškodený imunitný systém
- Poškodenie bunkových chromozómov a nedostatok červených telies v krvi;
- Poškodenie mozgu (poruchy spánku, bolesti hlavy, poruchy pamäte, podráždený stav).
Do životného prostredia
 Atómy cínu a samotný kov v čistom stave nie sú toxické pre žiadny organizmus na Zemi, naopak, takmer všetky zlúčeniny s týmto prvkom organickej povahy sú škodlivé. Tieto zlúčeniny môžu byť v prostredí po dlhú dobu. Sú dosť stabilné a prakticky sa nerozpadajú pod vplyvom mikroorganizmov kvôli ich silným vodíkovým väzbám. Bez ohľadu na to, aká nízka je koncentrácia zlúčenín tohto kovu v pôde a vode, vzhľadom na uvedené skutočnosti neustále rastú.
Atómy cínu a samotný kov v čistom stave nie sú toxické pre žiadny organizmus na Zemi, naopak, takmer všetky zlúčeniny s týmto prvkom organickej povahy sú škodlivé. Tieto zlúčeniny môžu byť v prostredí po dlhú dobu. Sú dosť stabilné a prakticky sa nerozpadajú pod vplyvom mikroorganizmov kvôli ich silným vodíkovým väzbám. Bez ohľadu na to, aká nízka je koncentrácia zlúčenín tohto kovu v pôde a vode, vzhľadom na uvedené skutočnosti neustále rastú.
O organických zlúčeninách cínu je známe, že spôsobujú veľké škody na vodných ekosystémoch, pretože sú toxické pre huby, riasy a fytoplanktón. Fytoplanktón je dôležitou súčasťou vodného ekosystému, pretože produkuje kyslík pre všetky ostatné živé organizmy tohto systému a je tiež dôležitou súčasťou potravinového reťazca. Toxicita zlúčenín cínu sa líši pre rôzne živé organizmy, napríklad tributylcín je toxický pre ryby a huby, zatiaľ čo trifenolový cín je pre fytoplanktón naj toxickejšou zlúčeninou.
Je tiež známe, že organické zlúčeniny tohto prvku majú negatívny vplyv na rast a reprodukčnú funkciu zvierat, narúšajú fungovanie enzýmov. Tieto zlúčeniny sa hromadia hlavne v horných vrstvách pôdy a vody.